Valneva confirme le calendrier des demandes d'autorisation pour son vaccin anti-Covid
06 Janvier 2022 - 7:59AM
Dow Jones News
PARIS (Agefi-Dow Jones)--La société de biotechnologie Valneva a
confirmé jeudi le calendrier des essais cliniques et des demandes
d'autorisation de mise sur le marché de son candidat vaccin
inactivé et adjuvanté contre le Covid-19, le VLA2001.
"Comme annoncé en décembre 2021, la société a commencé la
soumission progressive des demandes d'autorisation initiale de mise
sur le marché dé VLA2001 auprès de l'Agence européenne des
médicaments, de la MHRA du Royaume-Uni et de la NHRA de Bahreïn", a
indiqué Valneva dans un communiqué.
La biotech continue par ailleurs à travailler "en étroite
collaboration avec ces autorités pour qu'elles puissent compléter
leur processus d'examen suite aux résultats positifs de l'essai de
Phase 3".
Les autorisations réglementaires potentielles sont toujours
attendues au cours du premier trimestre et, sous réserve de
l'approbation réglementaire de l'Agence européenne des médicaments,
Valneva prévoit toujours de livrer son vaccin à l'Union européenne
en avril.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
January 06, 2022 01:39 ET (06:39 GMT)
Copyright (c) 2022 L'AGEFI SA
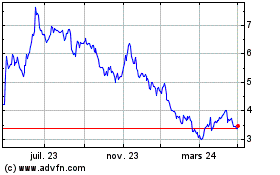
Valneva (EU:VLA)
Graphique Historique de l'Action
De Mar 2024 à Avr 2024
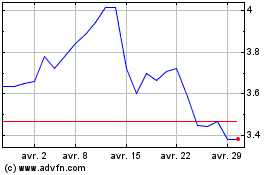
Valneva (EU:VLA)
Graphique Historique de l'Action
De Avr 2023 à Avr 2024