Valneva lance la demande d'autorisation de son vaccin contre le chikungunya aux USA
18 Août 2022 - 6:54PM
Dow Jones News
PARIS (Agefi-Dow Jones)--Valneva a annoncé jeudi soir avoir débuté
la soumission du dossier de demande d'autorisation de mise sur le
marché (AMM) auprès de l'autorité de santé américaine (FDA) pour
son candidat vaccin à injection unique contre le chikungunya
(VLA1553) chez les personnes âgées de 18 ans et plus.
Cette demande d'AMM fait suite aux données finales de Phase 3
annoncées en mars dernier et aux résultats finaux de l'essai
d'homogénéité des lots cliniques annoncés en mai dernier, a précisé
la société de biotechnologie.
Une étude clinique de VLA1553 chez les adolescents est en cours au
Brésil, afin de potentiellement permettre d'effectuer de futures
soumissions réglementaires concernant cette tranche d'âge si
VLA1553 est autorisé pour une utilisation chez les adultes.
Valneva prévoit d'achever la soumission du dossier fin 2022.
"Une fois que tous les éléments de la demande d'autorisation auront
été soumis et si le dossier est accepté, la FDA statuera sur
l'éligibilité du candidat vaccin à un examen prioritaire, ce qui
déterminera la date que la FDA visera pour achever son évaluation",
a ajouté Valneva.
-Vincent Alsuar, Agefi-Dow Jones; +33 (0)1 41 27 47 39;
valsuar@agefi.fr ed: TVA
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
August 18, 2022 12:34 ET (16:34 GMT)
Copyright (c) 2022 L'AGEFI SA
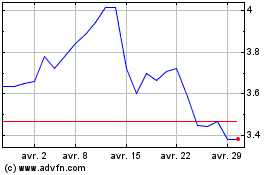
Valneva (EU:VLA)
Graphique Historique de l'Action
De Mar 2024 à Avr 2024
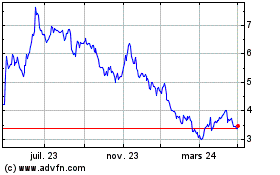
Valneva (EU:VLA)
Graphique Historique de l'Action
De Avr 2023 à Avr 2024