Covid-19: L'EMA accepte la soumission du dossier d'autorisation du vaccin de Valneva
19 Mai 2022 - 8:05AM
Dow Jones News
PARIS (Agefi-Dow Jones)--La société de biotechnologie Valneva a
indiqué jeudi que l'Agence européenne du médicament (EMA) avait
accepté la soumission du dossier d'autorisation de mise sur le
marché de son vaccin inactivé à virus entier contre le Covid-19,
VLA2001.
"L'acceptation du dossier signifie que VLA2001 sort du processus de
revue progressive des données pour rentrer dans le processus formel
d'évaluation par le comité des médicaments à usage humain (CHMP) de
l'EMA", a indiqué Valneva dans un communiqué. "Si le CHMP accepte
la demande d'autorisation conditionnelle de mise sur le marché de
Valneva, la société confirme qu'elle pourrait obtenir une opinion
positive du CHMP en juin 2022", a ajouté la biotech.
Si le CHMP émet un avis positif, la Commission européenne examinera
ensuite la recommandation et rendra une décision finale sur
l'autorisation de mise sur le marché concernant VLA2001.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
May 19, 2022 01:45 ET (05:45 GMT)
Copyright (c) 2022 L'AGEFI SA
Valneva (EU:VLA)
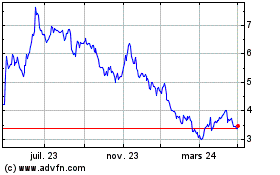
Graphique Historique de l'Action
De Mar 2024 à Avr 2024
Valneva (EU:VLA)
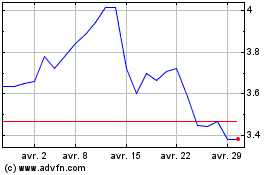
Graphique Historique de l'Action
De Avr 2023 à Avr 2024