ABIONYX Pharma reçoit un avis positif de l'EMA pour le CER-001 dans la Déficience en LCAT
21 Octobre 2024 - 8:00PM
Business Wire
- Acceptation par l’EMA de la soumission de données provenant
de deux lots prospectifs de validation du procédé de fabrication du
biomédicament au moment de la demande d'autorisation de mise sur le
marché (AMM)
Regulatory News :
ABIONYX Pharma, (FR0012616852 – ABNX – éligible PEA PME),
société de biotechnologie de nouvelle génération dédiée à la
découverte et au développement de thérapies innovantes basées sur
la seule apolipoprotéine apoA-1 recombinante au monde, a soumis le
11 juillet 2024 une demande formelle d'avis scientifique à l'Agence
européenne des médicaments (EMA) pour l'apolipoprotéine A-I humaine
recombinante CER-001, dans le traitement de la déficience en
lécithine-cholestérol acyltransférase(LCAT). Cette demande complète
le processus d'examen continu, avec des données cliniques et des
données partielles sur la chimie, la fabrication et les contrôles
(CMC) soumises par ABIONYX Pharma.
ABIONYX Pharma a sollicité l’avis du Comité des médicaments à
usage humain (CHMP), comité de l'Agence européenne des médicaments
responsable de l’évaluation des médicaments à usage humain, sur la
proposition de soumettre, lors du dépôt du dossier relatif au
CER-001 en vue de l'octroi de l'approbation conditionnelle de l'UE
dans l'indication de la Déficience LCAT, les données de deux lots
prospectifs de validation du procédé relatif à la fabrication du
biomédicament (qui comprend la substance apoA-I dite DS et le
produit médicamenteux dit DP).
L'EMA a conclu que la proposition de soumettre les données
provenant de 2 lots prospectifs de validation du procédé relatif à
la fabrication du biomédicament lors de la demande d'AMM pourrait
être admissible.
Comme recommandé, ABIONYX Pharma poursuivra son plan de
développement concernant la sécurité virale, la description de la
méthode et la spécificité de la validation jusqu'à la soumission de
l'AMM.
ABIONYX Pharma a fourni le CER-001 dans le cadre d'une
utilisation compassionnelle nominative à huit patients souffrant
d'une déficience LCAT dans quatre pays européens. Tous les patients
ont maintenant achevé les six mois de traitement. Comme convenu
dans l'avis précédent du CHMP, ces cas constitueront la base
clinique de la soumission de l'AMM.
Sur la base de l'avis scientifique de l'EMA, la Société a
maintenant clarifié les conditions requises pour initier le
processus de soumission d'une AMM.
A propos de CER-001
CER-001 est une particule HDL synthétique qui contient de
l'apolipoprotéine A-I humaine recombinante (apoA-I), complexée avec
des phospholipides. Les particules HDL se sont révélées être des
piégeurs très efficaces d'endotoxines bactériennes, telles que le
lipopolysaccharide (LPS), avec la capacité d'inactiver le LPS et de
le cibler pour qu'il soit éliminé par le foie. De plus, sa capacité
importante à épurer le cholesterol et des lipides accumulés dans
les tissus (en particulier renaux) fait du CER-001 un outil de
choix dans le traitement de la maladie de Norum.
A propos d’ABIONYX Pharma
ABIONYX Pharma est une société biotech de nouvelle génération
qui entend contribuer à la santé grâce à des thérapies innovantes
dans des indications sans traitement efficace ou existant, même les
plus rares. Grâce à ses partenaires chercheurs, médecins,
producteurs de biomédicaments et actionnaires, la société innove
quotidiennement pour proposer des médicaments pour le traitement
des maladies rénales et ophtalmologiques, ou de nouveaux vecteurs
HDL utilisés pour la délivrance ciblée de médicaments.
Consultez la
version source sur businesswire.com : https://www.businesswire.com/news/home/20241021087638/fr/
NewCap Relations investisseurs Louis-Victor Delouvrier
Nicolas Fossiez abionyx@newcap.eu +33 (0)1 44 71 94 94
NewCap Relations médias Arthur Rouillé abionyx@newcap.eu +33
(0)1 44 71 94 98
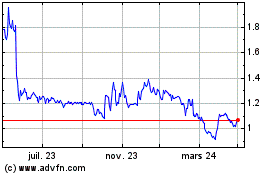
Abionyx Pharma (EU:ABNX)
Graphique Historique de l'Action
De Nov 2024 à Déc 2024
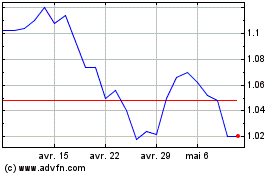
Abionyx Pharma (EU:ABNX)
Graphique Historique de l'Action
De Déc 2023 à Déc 2024