La FDA autorise le Kevzara de Sanofi et Regeneron pour traiter la polymyalgie
01 Mars 2023 - 7:41AM
Dow Jones News
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi et la
société américaine de biotechnologies Regeneron ont annoncé dans la
nuit de mardi à mercredi que la Food and Drug Administration (FDA),
l'autorité sanitaire américaine, avait autorisé le Kevzara
(sarilumab) pour le traitement de la polymyalgie rhumatismale (PMR)
de l'adulte.
Le Kevzara devient ainsi le premier et seul médicament biologique
indiqué pour les patients atteints de polymyalgie rhumatismale, ont
indiqué dans un communiqué commun Sanofi et Regeneron, qui
développent conjointement le sarilumab dans le cadre d'un accord de
collaboration mondial.
"La polymyalgie rhumatismale peut être une maladie incapacitante,
provoquant des poussées douloureuses dans plusieurs parties du
corps, qui fatiguent les personnes et les empêchent d'accomplir
pleinement leurs activités quotidiennes", ont ajouté les
partenaires.
L'approbation du Kevzara par la FDA pour le traitement de la
polymyalgie rhumatismale est basée sur les résultats de l'essai
clinique randomisé de phase 3 SAPHYR chez des patients atteints de
PMR active résistante aux stéroïdes.
Le Kevzara était déjà approuvé dans plusieurs pays pour le
traitement de la polyarthrite rhumatoïde active modérée à sévère de
l'adulte ayant présenté une réponse inadéquate ou une intolérance à
un ou plusieurs traitements antérieurs.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: LBO
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
March 01, 2023 01:21 ET (06:21 GMT)
Copyright (c) 2023 L'AGEFI SA
Sanofi (EU:SAN)
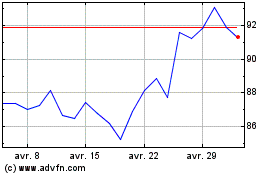
Graphique Historique de l'Action
De Mar 2024 à Avr 2024
Sanofi (EU:SAN)
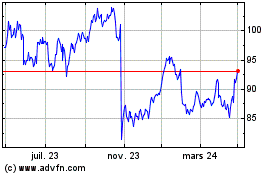
Graphique Historique de l'Action
De Avr 2023 à Avr 2024