Genfit: la FDA autorise l'essai de phase 2 d'elafibranor dans la NASH pédiatrique
11 Mars 2019 - 9:05AM
Dow Jones News
PARIS (Agefi-Dow Jones)--Genfit a annoncé lundi que l'autorité
sanitaire américaine, la Food & Drug Administration (FDA), a
accepté son protocole d'étude l'autorisant à initier un essai
clinique de phase 2 évaluant elafibranor chez des enfants ou
adolescents atteints de stéatohépatite non-alcoolique, ou NASH,
appelée aussi "maladie du foie gras".
Développée par Genfit, elafibranor est la première molécule ayant
délivré des résultats positifs chez l'adulte à être évaluée dans la
NASH pédiatrique. "Elafibranor est en position idéale pour être
évalué chez l'enfant et l'adolescent atteint de NASH, au regard de
ses résultats concluants de Phase 2 dans la NASH adulte", a indiqué
la société de biotechnologie dans un communiqué de presse.
L'essai clinique sera conduit sur vingt patients pédiatriques
pendant douze semaines dans des centres cliniques américains.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
March 11, 2019 03:45 ET (07:45 GMT)
Copyright (c) 2019 L'AGEFI SA
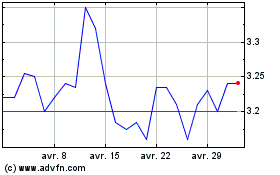
Genfit (EU:GNFT)
Graphique Historique de l'Action
De Mar 2024 à Avr 2024
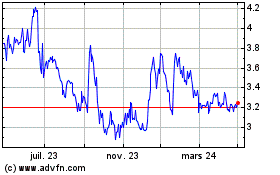
Genfit (EU:GNFT)
Graphique Historique de l'Action
De Avr 2023 à Avr 2024