Sanofi - Fin De La Correction ? (SAN)
-
22/6/2015 11:23
 0
0
zebulon1
Messages postés: 180 -
Membre depuis: 14/11/2014
| Intraday Stock Chart: Sanofi | Graphiques historiques: Sanofi | 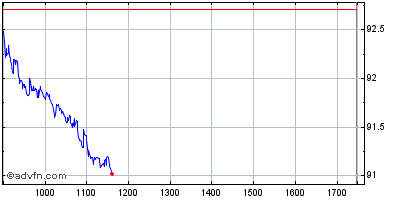 | 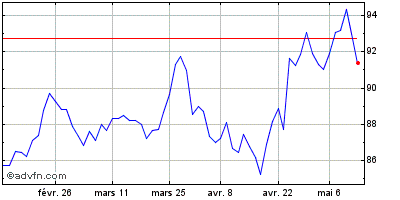 |
Signal d'achat si on casse 89.92€ (analyse centralcharts).
Graphique journalier :

|
|
Réponses
103 Réponses
|
41 de 103
-
01/6/2021 08:08
 0
0
waldron
Messages postés: 9816 -
Membre depuis: 17/9/2002
Sanofi met fin à une étude sur le venglustat dans le traitement de la polykystose rénale
01 Juin 2021 - 07:52AM
Dow Jones News
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
mardi avoir mis un terme au programme clinique visant à évaluer le
venglustat dans le traitement de la polykystose rénale autosomique
dominante (PKD).
"Une étude pivot de phase II/III consacrée au venglustat dans le
traitement de la polykystose rénale autosomique dominante n'a pas
atteint son critère de futilité et Sanofi a mis un terme au
programme clinique dans cette indication", a indiqué le groupe dans
un communiqué.
La PKD, une maladie génétique provoquant des kystes rénaux, est
l'une des principales causes de transplantation rénale.
Selon les données issues d'une analyse intermédiaire, "la réduction
des taux de glycosphingolipides (GSL) pourrait ne pas jouer un rôle
significatif dans la prévention de la croissance des kystes rénaux
et, à ce titre, pourrait ne pas être la voie principale mise en
cause dans la progression de la maladie", a expliqué le groupe.
"Les recherches expérimentales menées sur le venglustat dans le
traitement de la PKD avaient pour but d'étudier une nouvelle
fonction biologique des GSL au-delà de celle, bien établie, que
jouent ces lipides dans les maladies de surcharge lysosomale", a
rappelé Sanofi.
Le venglustat est un traitement expérimental de fond, par voie
orale, qui a le potentiel de ralentir la progression de certaines
maladies en inhibant l'accumulation anormale de GSL.
"Sanofi a mené et continue de mener des études dans le but
d'évaluer le venglustat dans le traitement de la maladie de Gaucher
de type 3 et de la gangliosidose à GM2, deux maladies de surcharge
lysosomale causées par des déficits génétiques héréditaires", a
précisé le groupe.
-Alice Doré, Agefi-Dow Jones; +33 (0)1 41 27 47 90; adore@agefi.fr
ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
June 01, 2021 01:36 ET (05:36 GMT)
|
42 de 103
-
28/6/2021 09:05
 0
0
adrian j boris
Messages postés: 302 -
Membre depuis: 28/6/2018
Sanofi cède 16 produits de santé grand public à l'allemand Stada
28 Juin 2021 - 07:25AM
Dow Jones News
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé lundi avoir signé un accord avec le groupe allemand Stada en vue de la cession de 16 de ses produits de santé grand public commercialisés en Europe. Le montant de la transaction n'a pas été précisé.
"L'accord porte sur les marques enregistrées, les marques et les droits de commercialisation de 16 produits vendus dans différents pays européens", a indiqué Sanofi dans un communiqué.
"Comme nous l'avions indiqué lors de notre Capital Markets Day de février, la simplification du portefeuille de produits Santé Grand Public est un aspect important de notre stratégie qui consiste à concentrer nos ressources et nos efforts là où nous pouvons apporter le plus de valeur, en particulier pour les consommateurs", a déclaré Julie Van Ongevalle, la vice-présidente exécutive de Sanofi Santé Grand Public, citée dans ce communiqué.
L'opération devrait être clôturée au troisième trimestre de cette année, sous réserve de l'approbation des autorités de régulation et d'autres conditions habituelles.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31; ddelmond@agefi.fr ed: LBO
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
June 28, 2021 02:09 ET (06:09 GMT)
|
43 de 103
-
05/7/2021 09:21
 0
0
Grupo GuitarLumber
Messages postés: 1716 -
Membre depuis: 24/6/2003
Le vaccin de Sanofi contre le Covid sera disponible d'ici à décembre -président France
05 Juillet 2021 - 08:39AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le vaccin de Sanofi contre le Covid-19
sera disponible d'ici à décembre prochain, a confirmé lundi Olivier
Bogillot, le président du groupe pharmaceutique en France sur les
ondes de France Inter.
Le candidat-vaccin de Sanofi et de son partenaire, le laboratoire
britannique GlaxoSmithKline (GSK), est développé selon la
technologie éprouvée dite de la protéine recombinante, identique à
celle utilisée pour la fabrication du vaccin contre la grippe. Le
produit fait l'objet depuis le mois de mai d'une étude clinique de
phase 3.
"Le vaccin pourrait être approuvé et autorisé au quatrième
trimestre de 2021, sous réserve de résultats positifs de phase 3 et
des évaluations réglementaires", avait indiqué Sanofi lors de
l'annonce du lancement de cette étude.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
July 05, 2021 02:19 ET (06:19 GMT)
|
44 de 103
-
29/7/2021 08:04
 0
0
waldron
Messages postés: 9816 -
Membre depuis: 17/9/2002
Sanofi relève son objectif de BNPA pour 2021 après avoir dépassé les attentes au S1
29 Juillet 2021 - 07:48AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a relevé
jeudi sa prévision de croissance du résultat net par action (BNPA)
de ses activités pour 2021, désormais attendu en amélioration de
l'ordre de 12% sur l'année, après avoir enregistré une progression
de 16% de cet indicateur au premier semestre, à taux de change
constants.
"Notre performance s'est accélérée au deuxième trimestre, ce qui
s'est traduit par de solides résultats financiers, portés par nos
moteurs de croissance clés, Dupixent et les vaccins", a commenté
Paul Hudson, le directeur général de Sanofi, cité dans un
communiqué.
Sur l'ensemble du premier semestre, le résultat net des activités,
l'indicateur de rentabilité utilisé par Sanofi qui exclut l'effet
des cessions et des acquisitions, a progressé de 6,4% en données
publiées et de 15,6% à taux de change constants, à 3,75 milliards
d'euros.
Le BNPA des activités du semestre a augmenté de 16% à taux de
change constants, à 3 euros, dont 1,38 euro au deuxième trimestre
(+16,4%). Les analystes attendaient un BNPA de 1,33 euro par action
pour le trimestre écoulé, soit 2,94 euros pour l'ensemble du
premier semestre.
Fort d'une hausse supérieure aux attentes de son BNPA des activités
au premier semestre, Sanofi a revu en hausse sa prévision de
croissance pour cet indicateur en 2021. Cette année, le BNPA des
activités devrait s'inscrire en croissance "de l'ordre de 12%",
alors qu'il était précédemment attendu "dans une fourchette située
dans le haut de la première dizaine".
Le chiffre d'affaires du semestre écoulé est ressorti en hausse de
0,9%, à 17,36 milliards d'euros. A taux de change constants, la
croissance a atteint 7,2%. Sur la période, Sanofi a bénéficié du
fort dynamisme commercial de sa division Médecine de spécialités,
dont les revenus ont bondi de 18,7% à taux de change constants, à
5,98 milliards d'euros, portés par Dupixent (+51,4%, à 2,29
milliards d'euros).
Les analystes prévoyaient en moyenne un chiffre d'affaires de 17,46
milliards d'euros, selon le consensus réalisé par Factset.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
COMMUNIQUES FINANCIERS DE SANOFI :
http://www.sanofi.com/investisseurs/actualites_pub...
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
July 29, 2021 01:30 ET (05:30 GMT)
|
45 de 103
-
03/8/2021 09:32
 0
0
sarkasm
Messages postés: 1319 -
Membre depuis: 26/2/2009
Sanofi va lancer une OPA sur Translate Bio pour environ 2,7 milliards d'euros
03 Août 2021 - 06:43AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
mardi avoir conclu un accord définitif avec Translate Bio en vue de
l'acquisition de la totalité des actions en circulation de la
société américaine spécialisée dans le développement clinitique de
médicaments à ARN messager (ARNm) au prix de 38 dollars par
action.
La transaction, entièrement libellée en numéraire, valorise
Translate Bio à environ 3,2 milliards de dollars (2,7 milliards
d'euros) sur une base entièrement diluée, a indiqué Sanofi dans un
communiqué.
"Le prix d'achat représente une prime de 56% du cours moyen pondéré
par les volumes de l'action Translate Bio au cours des 60 derniers
jours", a précisé le laboratoire français.
L'offre publique d'achat (OPA) devrait débuter dans le courant du
mois d'août et l'opération devrait être finalisée au troisième
trimestre, a indiqué Sanofi, qui prévoit de financer cette
opération avec sa trésorerie disponible.
"Les conseils d'administration de Sanofi et de Translate Bio ont
approuvé cette transaction à l'unanimité", a ajouté Sanofi, en
soulignant que le directeur général de l'entreprise américaine et
son principal actionnaire, The Baupost Group, ont signé des
engagements contraignants en faveur de l'offre.
"Combinés aux actions Translate Bio déjà détenues par Sanofi ou ses
filiales", ces engagements contraignants représentent environ 30%
du nombre total d'actions Translate Bio en circulation, a précisé
Sanofi.
"A la suite de la clôture de l'offre, une filiale intégralement
détenue par Sanofi fusionnera avec Translate Bio et toutes les
actions qui n'auront pas été apportées à l'offre publique d'achat
seront converties en un droit à recevoir 38 dollars au comptant par
action", a précisé le groupe pharmaceutique.
-Alice Doré, Agefi-Dow Jones; +33 (0) 1 41 27 47 90; adore@agefi.fr
ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
August 03, 2021 01:27 ET (05:27 GMT)
|
47 de 103
-
30/8/2021 08:01
 0
0
waldron
Messages postés: 9816 -
Membre depuis: 17/9/2002
Sanofi: le Dupixent atteint tous les critères d'évaluation dans un essai de phase 3
30 Août 2021 - 07:48AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
lundi qu'un essai pivot de phase 3 évaluant le Dupixent chez des
enfants âgés de six mois à cinq ans présentant une dermatite
atopique modérée à sévère avait atteint tous ses critères
d'évaluation primaires et secondaires.
La dermatite atopique est une maladie inflammatoire chronique de la
peau qui peut être invalidante.
"Les résultats de cet essai montrent qu'à 16 semaines, l'ajout de
Dupixent à des corticoïdes à usage topique permet de réduire
significativement la sévérité globale de la maladie et d'améliorer
la cicatrisation de la peau, les démangeaisons et les indicateurs
de la qualité de vie en lien avec la santé, comparativement à un
traitement par corticoïdes à usage topique seulement", a indiqué
Sanofi dans un communiqué.
En association avec des corticoïdes à usage topique, le Dupixent a
permis de réduire de 70% la sévérité globale de la maladie et de
49% les démangeaisons, a révélé cette étude dont les résultats
détaillés seront présentés dans le cadre d'un prochain congrès
médical. Les données correspondantes seront soumises aux autorités
réglementaires, a ajouté Sanofi.
Le Dupixent est le premier médicament biologique ayant permis
d'obtenir des résultats positifs auprès de jeunes patients et reste
le seul médicament biologique approuvé pour les patients atteints
de dermatite atopique modérée à sévère non contrôlée, dès l'âge de
six ans.
En 2016, la Food and Drug Administration (FDA), l'autorité
sanitaire américaine, a décerné le statut de "médicament innovant"
("Breakthrough Therapy") au Dupixent pour le traitement de la
dermatite atopique chez les enfants âgés de six mois à 11 ans.
Le Dupixent est développé conjointement par Sanofi et Regeneron
dans le cadre d'un accord de collaboration mondiale.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
August 30, 2021 01:28 ET (05:28 GMT)
|
48 de 103
-
28/9/2021 10:48
 0
0
gibbs1
Messages postés: 90 -
Membre depuis: 10/11/2019
UPDATE: Sanofi cesse le développement de son vaccin à ARN messager contre le Covid-19
28 Septembre 2021 - 08:51AM
Dow Jones News
Alerte
Imprimer
Share On Facebook
(Actualisation: déclaration d'une porte-parole et cours de Bourse)
PARIS (Agefi-Dow Jones)--Sanofi a décidé d'arrêter le développement de son vaccin à ARN messager (ARNm) contre le virus SARS-CoV-2, mis en cause dans le Covid-19, au stade de l'étude clinique de phase I/II, a indiqué mardi une porte-parole du laboratoire pharmaceutique à l'agence Agefi-Dow Jones.
"Le lancement d'une phase III ne répondait pas un besoin immédiat de santé publique, parce que le produit arriverait trop tard sur le marché", a expliqué cette porte-parole. Toujours sur le front du Covid-19, "Sanofi se concentre donc sur son candidat vaccin à protéine recombinante pour répondre aux besoins de la vaccination de rappel", a-t-elle ajouté.
Sanofi prévoit toujours la mise sur le marché avant la fin de cette année de son vaccin développé selon la technologie éprouvée dite de la protéine recombinante avec adjuvant. Conçu en partenariat avec le laboratoire britannique GlaxoSmithKline, ce produit fait l'objet depuis le mois de mai d'une étude clinique de phase III.
Les résultats intermédiaires de l'étude clinique de phase I/II consacrée au candidat-vaccin à ARNm de Sanofi contre le Covid-19 se sont toutefois montrés encourageants. Ils confirment "le potentiel de la plateforme de Translate Bio récemment acquise en matière d'ARNm et de nanoparticules lipidiques, et confortent la stratégie de l'entreprise concernant le développement de vaccins et d'agents thérapeutiques à base d'ARNm", a indiqué Sanofi dans un communiqué envoyé mardi.
Sanofi compte ainsi utiliser cette plateforme pour le développement de vaccins contre d'autres pathologies. Le groupe pharmaceutique français indique viser l'initiation, en 2022, d'études cliniques sur un vaccin contre la grippe à base d'ARNm modifié. Un essai clinique de phase I a déjà été lancé par Sanofi en juin 2021 pour évaluer un vaccin expérimental à base d'ARNm contre la grippe saisonnière.
A la Bourse de Paris, l'action Sanofi progresse de 0,3%, à 82,35 euros, tandis que l'indice CAC 40 plie de 0,7%.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31; ddelmond@agefi.fr ed: VLV - ECH
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
September 28, 2021 03:31 ET (07:31 GMT)
|
49 de 103
-
01/11/2021 12:07
 0
0
gibbs1
Messages postés: 90 -
Membre depuis: 10/11/2019
PARIS (Agefi-Dow Jones)--L'action Sanofi gagne 2,4%, à 88,49 euros, soutenue par un relèvement de recommandation de la part de HSBC, qui a revu son conseil sur le groupe pharmaceutique de "conserver" à "acheter" et a rehaussé son objectif de cours de 89 euros à 100 euros. La banque considère que le groupe a augmenté son levier opérationnel, et prévoit en conséquence qu'il augmentera sa marge opérationnelle de quatre points de pourcentage d'ici à 2025, à 30,7% contre un taux de 26,7% prévu en 2021. (jmarion@agefi.fr) ed : LBO
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
November 01, 2021 05:09 ET (09:09 GMT)
|
50 de 103
-
24/11/2021 14:42
 0
0
Grupo GuitarLumber
Messages postés: 1716 -
Membre depuis: 24/6/2003
Déjà positif sur le
dossier, la recherche de chez UBS et son analyste Laura Sutcliffe
considèrent toujours le titre comme une opportunité d'achat. L'objectif
de cours continue d'être situé à 100 EUR.
|
51 de 103
-
01/12/2021 09:16
 0
0
waldron
Messages postés: 9816 -
Membre depuis: 17/9/2002
Sanofi confirme viser une croissance de plus de 5% par an dans les vaccins à moyen terme
01 Décembre 2021 - 08:33AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a confirmé
mercredi, en amont d'une conférence dédiée aux investisseurs, viser
une croissance annuelle moyenne comprise entre 5% et 10% dans les
vaccins.
Entre 2018 et 2025, Sanofi compte parvenir à un taux de croissance
annuel composé, à "un chiffre, situé dans une fourchette moyenne à
supérieure", c'est-à-dire compris entre 5% et 10%. Le groupe a
également pour objectif de plus que doubler les ventes de cette
activité d'ici à la fin de la décennie par rapport à leur niveau de
2018.
"Cette croissance soutenue sera portée par quatre grandes
franchises - grippe, méningite, vaccins PPH (polio, coqueluche et
Hib, NDLR) et vaccins de rappels -, ainsi que par nirsevimab,
premier anticorps monoclonal pour la protection de tous les
nourrissons contre les infections causées par le virus respiratoire
syncytial (VRS), dont le lancement est prévu prochainement", a
indiqué Sanofi dans un communiqué.
Le groupe pharmaceutique estime que ces franchises devraient lui
permettre de capter au mieux la croissance de ces marchés,
notamment celui des vaccins contre la grippe que Sanofi évalue à
plus de 15 milliards d'euros d'ici à 2030.
"En tant que leader mondial des vaccins, nous sommes
particulièrement bien placés pour réaliser tout le potentiel des
vaccins grâce à l'intensification de nos recherches sur la nouvelle
génération de vaccins à ARN messager et sur d'autres technologies
permettant de prévenir les maladies", a indiqué Thomas Triomphe,
vice-président exécutif de Sanofi Pasteur, cité dans un
communiqué.
Sur les dix nouveaux candidats vaccins qui doivent entrer en stade
clinique d'ici à 2025, six feront appel à l'ARN messager pour
cibler des maladies pour lesquelles les besoins non pourvus sont
importants, comme la chlamydia et l'acné, a indiqué Sanofi.
Pour ces deux dernières maladies, le groupe a annoncé que les
essais de phase I débuteraient en 2023.
Dans le cas de l'acné, Sanofi a paralèlement annoncé mercredi
l'acquisition de la société de biotechnologie autrichienne Origimm
Biotechnology. Cette opération permettra d'ajouter "ORI-001", le
candidat vaccin contre l'acné d'Origimm Biotechnology, à son
portefeuille de projets à un stade précoce de développement.
-Julien Marion, Agefi-Dow Jones; +33 (0)1 41 27 47 94;
jmarion@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
December 01, 2021 02:13 ET (07:13 GMT)
|
52 de 103
-
11/12/2021 07:42
 0
0
sarkasm
Messages postés: 1319 -
Membre depuis: 26/2/2009
Dans sa dernière
note de recherche, l'analyste Richard Vosser confirme sa recommandation
positive. Le broker JP Morgan était déjà précédemment à l'achat.
L'objectif de cours est inchangé à 105 EUR.
|
53 de 103
-
04/2/2022 10:02
 0
0
waldron
Messages postés: 9816 -
Membre depuis: 17/9/2002
CORR: Sanofi a battu le consensus en 2021 et vise une nouvelle hausse de ses résultats en 2022
04 Février 2022 - 08:49AM
Dow Jones News
Alerte
Imprimer

(Correction: bien lire au troisième paragraphe que Sanofi avait
indiqué viser un BNPA des activités en croissance de 14% à taux de
change constants en 2021 et non en 2020 comme écrit par erreur dans
une dépêche publiée à 7h32)
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a indiqué
vendredi viser une nouvelle progression de son bénéfice net par
action (BNPA) des activités en 2022, après que cet indicateur a
dépassé ses prévisions en 2021.
Sur l'ensemble de l'exercice écoulé, le bénéfice net des activités
de Sanofi - qui correspond au résultat net hors impact des cessions
et acquisitions - a progressé de 11,8% en données publiées, à 8,21
milliards d'euros. A taux de change constants, le résultat net des
activités a crû de 15,5%. Selon le consensus élaboré par FactSet,
les analystes anticipaient en moyenne un résultat net des activités
de 8,09 milliards d'euros pour l'exercice 2021 du groupe
pharmaceutique.
Ainsi, le BNPA des activités est ressorti à 6,56 euros l'an passé,
s'inscrivant en hausse de 15,5% à taux de change constants et
dépassant l'objectif de croissance fixé par les dirigeants. Fin
octobre, à l'occasion de la publication de ses comptes du troisième
trimestre, Sanofi avait indiqué viser un BNPA des activités en
croissance de 14% à taux de change constants en 2021, contre une
progression de 12% attendue précédemment. Les analystes tablaient,
en moyenne, sur un BNPA des activités de 6,49 euros pour le dernier
exercice.
De son côté, le chiffre d'affaires annuel a augmenté de 7,1% à taux
de change constants (+4,8% en données publiées), à 37,76 milliards
d'euros.
Le Dupixent a tiré les ventes du dernier trimestre
Sanofi est parvenu à atteindre son objectif de BNPA des activités
fixé pour 2021 grâce à une "performance solide" au quatrième
trimestre, "portée par une croissance à deux chiffres des ventes de
Dupixent qui atteignent un nouveau record chaque trimestre", a
indiqué Paul Hudson, le directeur général du groupe, cité dans un
communiqué.
Sur la période, le bénéfice net des activités a atteint 1,73
milliard d'euros, en amélioration de 13,3% en données publiées et
de 10,2% à taux de change constants. Ce montant est supérieur à
l'estimation moyenne de 1,68 milliard d'euros des analystes
interrogés par FactSet.
Le chiffre d'affaires de Sanofi s'est établi à 9,99 milliards
d'euros au dernier trimestre, en hausse de 6,5% en données publiées
et de 4,1% à taux de change constants. Le Dupixent, dont les ventes
ont bondi de 53,1% à 1,55 milliard d'euros, a été le principal
contributeur à la croissance organique.
Les résultats de l'étude sur le vaccin contre le Covid-19
arrivent
Pour 2022, les dirigeants de Sanofi tablent sur une hausse du BNPA
"dans une fourchette située dans le bas de la première dizaine" à
taux de change constants. L'effet positif des changes sur le BNPA
des activités en 2022 est estimé entre 2% et 3% en appliquant les
taux de change moyens de janvier 2022, a indiqué Sanofi dans un
communiqué.
"Notre excellente performance financière confirme notre capacité à
accroître notre rentabilité par l'amélioration de notre mix
produits, par le contrôle de nos dépenses et par le
réinvestissement de nos économies dans nos moteurs de croissance",
a ajouté Paul Hudson.
S'agissant de la recherche d'un vaccin contre le nouveau
coronavirus, responsable de la maladie Covid-19, Sanofi continue à
travailler sur son candidat-vaccin à base de protéines
recombinantes adjuvantées, développé en partenariat avec le groupe
britannique GSK, dont les résultats sont attendus au premier
trimestre de cette année. Sanofi a l'intention de déposer des
données de rappel auprès des autorités sanitaires à la suite des
résultats de la phase 3 en cours.
Signe de la confiance du groupe en l'avenir, le conseil
d'administration compte proposer à la prochaine assemblée générale
le versement d'un dividende de 3,33 euros par action au titre de
l'exercice 2021, en hausse de 4,1% sur un an.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: LBO
COMMUNIQUES FINANCIERS DE SANOFI :
Publications actionnaires - Sanofi
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
February 04, 2022 02:29 ET (07:29 GMT)
|
54 de 103
-
07/2/2022 07:52
 0
0
grupo
Messages postés: 1061 -
Membre depuis: 11/5/2004
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
vendredi soir que la Food and drug administration (FDA), l'autorité de
santé américaine, avait approuvé son médicament Enjaymo, pour réduire le
recours aux transfusions de globules rouges afin de traiter l'hémolyse
chez l'adulte atteint de la maladie des agglutinines froides (MAF).
"Enjaymo est le seul traitement approuvé permettant de réduire le
recours aux transfusions sanguines pour traiter l'hémolyse, ou
destruction des globules rouges, chez l'adulte atteint de la MAF", a
indiqué Sanofi dans un communiqué. Désigné "médicament innovant" et
"médicament orphelin" par la FDA, Enjaymo devrait être disponible aux
Etats-Unis dans les prochaines semaines.
La MAF est une anémie hémolytique auto-immune rare causée par la
présence d'anticorps, nommés agglutinines froides, qui se fixent à la
surface des globules rouges et déclenchent un processus amenant le
système immunitaire à s'attaquer par erreur aux globules rouges sains,
provoquant leur destruction ou hémolyse.
"Les globules rouges ayant pour fonction essentielle de transporter
l'oxygène dans l'organisme, les patients atteints d'une MAF peuvent
présenter une anémie sévère provoquant de la fatigue, des faiblesses,
des essoufflements, des vertiges, une douleur thoracique, une fréquence
cardiaque irrégulière et d'autres complications potentielles", a indiqué
Sanofi. "La MAF est une maladie chronique rare du sang qui, selon les
estimations, concerne près de 5.000 personnes aux Etats-Unis", a ajouté
le laboratoire pharmaceutique.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31; ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
February 07, 2022 01:44 ET (06:44 GMT)
|
55 de 103
-
21/2/2022 08:46
 0
0
Florenceorbis
Messages postés: 515 -
Membre depuis: 18/8/2017
Sanofi : Berenberg reste à conserver avec un objectif de cours relevé de 92 à 100 EUR.
|
56 de 103
-
28/2/2022 08:24
 0
0
sarkasm
Messages postés: 1319 -
Membre depuis: 26/2/2009
Sanofi: des résultats confortent les profils de tolérance et de sécurité du Dupixent
28 Février 2022 - 07:10AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le laboratoire pharmaceutique Sanofi a
annoncé samedi que des résultats d'essais cliniques confortaient
les profils de tolérance et de sécurité de son médicament Dupixent
pour le traitement des patients souffrant d'urticaire chronique
spontanée (UCS) ou d'oesophagite à éosinophiles.
Ces résultats "de dernière minute" ont été présentés par Sanofi
lors du congrès annuel de l'American Academy of Allergy, Asthma and
Immunology (AAAAI), qui se déroule jusqu'à lundi à Phoenix, dans
l'Arizona.
Dans le cadre de ce congrès, des résultats détaillés d'un essai de
phase 3 ont montré que l'ajout du Dupixent à des antihistaminiques
a permis d'obtenir une diminution près de deux fois plus importante
des démangeaisons et de l'activité de l'urticaire, comparativement
au traitement de référence seulement, avec des améliorations
continues jusqu'à la semaine 24. "Les résultats de sécurité de cet
essai ont été similaires au profil de sécurité connu de Dupixent
dans ses indications dermatologiques approuvées", a indiqué Sanofi
dans un communiqué.
L'utilisation potentielle du Dupixent pour le traitement de l'UCS
est encore au stade du développement clinique et aucun organisme de
réglementation n'a encore pleinement évalué ses profils de sécurité
et d'efficacité dans cette indication.
Le laboratoire pharmaceutique a, par ailleurs, présenté lors de
l'AAAAI des résultats positifs détaillés d'un deuxième essai de
phase 3 démontrant qu'un traitement par Dupixent a
significativement amélioré les signes et symptômes de l'oesophagite
à éosinophiles à 24 semaines, comparativement à un placebo, chez
des patients de 12 ans et plus. "Les résultats de tolérance de
l'essai concordent avec le profil de tolérance connu de Dupixent
dans ses indications approuvées", a souligné Sanofi, qui prévoit
des soumissions réglementaires pour le Dupixent dans cette
indication aux États-Unis et ailleurs dans le monde en 2022.
En septembre 2020, la Food and Drug Administration (FDA),
l'autorité sanitaire américaine, a accordé la désignation de
"médicament innovant" (Breakthrough Therapy) au Dupixent pour le
traitement de l'oesophagite à éosinophiles des patients de 12 ans
et plus. En 2017, le Dupixent a également obtenu de la FDA le
statut de "médicament orphelin" pour le traitement potentiel de
l'oesophagite à éosinophiles.
L'utilisation potentielle du Dupixent pour le traitement de
l'oesophagite à éosinophiles est encore au stade du développement
clinique, car aucun organisme de réglementation n'a encore évalué
ses profils de sécurité et d'efficacité dans cette indication.
Le Dupixent, nom commercial du dupilumab, est développé
conjointement par Sanofi et Regeneron dans le cadre d'un accord de
collaboration global.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: JXM
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
February 28, 2022 01:50 ET (06:50 GMT)
|
57 de 103
-
28/2/2022 09:27
 0
0
sarkasm
Messages postés: 1319 -
Membre depuis: 26/2/2009
Sanofi : Stifel démarre le suivi à l'achat en visant 120 EUR.
|
58 de 103
-
14/3/2022 08:58
 0
0
maywillow
Messages postés: 1324 -
Membre depuis: 27/1/2002
Sanofi: un essai sur l'amcenestrant n'a pas atteint son critère d'évaluation primaire
14 Mars 2022 - 06:47AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
lundi que l'essai AMEERA-3 de phase 2 évaluant l'amcenestrant dans
le traitement du cancer du sein avancé ou métastasique n'avait pas
atteint son critère d'évaluation primaire, à savoir l'amélioration
de la survie des patientes sans progression de la maladie.
"Aucun nouveau signal de sécurité n'a été identifié et le profil de
sécurité de l'amcenestrant dans l'essai AMEERA-3 a été cohérent
avec celui observé dans le cadre d'études antérieures", a indiqué
Sanofi dans un communiqué.
Le groupe a, par ailleurs, indiqué qu'il allait poursuivre
l'évaluation des données de l'essai AMEERA-3 et collaborer avec les
investigateurs en vue de la publication de ses résultats
complets.
"Le programme d'essais cliniques en cours relatif à l'amcenestrant
se poursuit comme prévu, notamment les essais AMEERA-5 et
AMEERA-6", a ajouté Sanofi.
Ce programme a été conçu par Sanofi pour évaluer le potentiel de
l'amcenestrant comme traitement endocrinien de fond par voie orale
dans différents contextes et, en particulier, en association avec
du palbociclib pour le traitement de première ligne du cancer du
sein métastatique (AMEERA-5), ainsi que pour évaluer son potentiel
dans le traitement du cancer du sein au stade précoce en situation
adjuvante (AMEERA-6).
Le recrutement dans l'essai clinique AMEERA-5 de phase 3, lancé à
la fin de 2020, est complet, tandis que le recrutement dans l'essai
AMEERA-6 de phase 3 est en cours.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: JXM
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
March 14, 2022 02:27 ET (06:27 GMT)
|
59 de 103
-
02/4/2022 08:23
 0
0
waldron
Messages postés: 9816 -
Membre depuis: 17/9/2002
PARIS (Reuters) - Sanofi a annoncé vendredi que la
cotation en Bourse de Paris de sa filiale de principes actifs
pharmaceutiques EUROAPI interviendra le 6 mai prochain sur la base d'une
parité de distribution d'une action EUROAPI pour vingt-trois actions
Sanofi. Le groupe pharmaceutique avait annoncé le lancement de cette opération le 18 mars dernier. Dans un communiqué, Sanofi a confirmé qu'à l'issue de
la cotation, le groupe a l'intention de conserver environ 30% du capital
et des droits de vote d'EUROAPI. Sanofi a également confirmé que l'Etat prendra de son côté une part d'environ 12% via le fonds French Tech Souveraineté. "EUROAPI a pour objectif d'atteindre un chiffre
d'affaires consolidé d'environ 1 milliard d'euros et une marge de core
Ebitda égale ou supérieure à 14% en 2022 pour l'exercice clos le 31
décembre 2022", fait savoir Sanofi dans un communiqué. (Rédigé par Matthieu Protard, édité par Laetitia Volga)
|
60 de 103
-
04/4/2022 08:11
 0
0
maywillow
Messages postés: 1324 -
Membre depuis: 27/1/2002
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
lundi que la Food and Drug Administration (FDA), l'autorité sanitaire
américaine, avait accepté d'accorder un examen prioritaire à son
médicament Dupixent pour le traitement des patients de 12 ans et plus
souffrant d'oesophagite à éosinophiles.
"La FDA devrait rendre sa décision sur cette indication expérimentale le 3 août 2022", a indiqué Sanofi dans un communiqué.
L'examen prioritaire est accordé par la FDA aux médicaments qui ont le
potentiel d'améliorer significativement le diagnostic, le traitement ou
la prévention de maladies graves.
L'oesophagite à éosinophiles est une maladie chronique et évolutive
portant une signature inflammatoire de type 2 qui provoque des lésions
dans l'oesophage et entraîne des difficultés à avaler. Aux États-Unis,
cette maladie concerne environ 160.000 personnes sous traitement, dont
approximativement 48.000 ont connu de multiples échecs thérapeutiques.
Dupixent est développé conjointement par Sanofi et Regeneron depuis
plus de dix ans dans le cadre d'un accord de collaboration mondiale.
Plus de 400.000 patients présentant certaines formes de dermatite
atopique, d'asthme et de polypose naso-sinusienne ont été traités par ce
médicament dans le monde.
-Julien Marion, Agefi-Dow Jones; +33 (0)1 41 27 47 94; jmarion@agefi.fr ed: DID
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
April 04, 2022 01:26 ET (05:26 GMT)
|
|
103 Réponses
|
|
Messages à suivre: (103)
Dernier Message: 05/Fév/2024 07h40
|
|
 Hot Features
Hot Features
Sanofi met fin à une étude sur le venglustat dans le traitement de la polykystose rénale
01 Juin 2021 - 07:52AM
Dow Jones News
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
mardi avoir mis un terme au programme clinique visant à évaluer le
venglustat dans le traitement de la polykystose rénale autosomique
dominante (PKD).
"Une étude pivot de phase II/III consacrée au venglustat dans le
traitement de la polykystose rénale autosomique dominante n'a pas
atteint son critère de futilité et Sanofi a mis un terme au
programme clinique dans cette indication", a indiqué le groupe dans
un communiqué.
La PKD, une maladie génétique provoquant des kystes rénaux, est
l'une des principales causes de transplantation rénale.
Selon les données issues d'une analyse intermédiaire, "la réduction
des taux de glycosphingolipides (GSL) pourrait ne pas jouer un rôle
significatif dans la prévention de la croissance des kystes rénaux
et, à ce titre, pourrait ne pas être la voie principale mise en
cause dans la progression de la maladie", a expliqué le groupe.
"Les recherches expérimentales menées sur le venglustat dans le
traitement de la PKD avaient pour but d'étudier une nouvelle
fonction biologique des GSL au-delà de celle, bien établie, que
jouent ces lipides dans les maladies de surcharge lysosomale", a
rappelé Sanofi.
Le venglustat est un traitement expérimental de fond, par voie
orale, qui a le potentiel de ralentir la progression de certaines
maladies en inhibant l'accumulation anormale de GSL.
"Sanofi a mené et continue de mener des études dans le but
d'évaluer le venglustat dans le traitement de la maladie de Gaucher
de type 3 et de la gangliosidose à GM2, deux maladies de surcharge
lysosomale causées par des déficits génétiques héréditaires", a
précisé le groupe.
-Alice Doré, Agefi-Dow Jones; +33 (0)1 41 27 47 90; adore@agefi.fr
ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
June 01, 2021 01:36 ET (05:36 GMT)