Sanofi - Fin De La Correction ? (SAN)
-
22/6/2015 11:23
 0
0
zebulon1
Messages postés: 180 -
Membre depuis: 14/11/2014
| Intraday Stock Chart: Sanofi | Graphiques historiques: Sanofi | 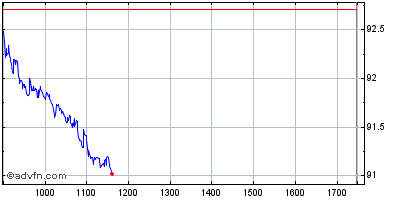 | 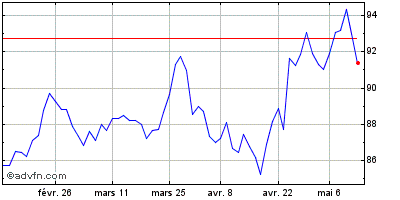 |
Signal d'achat si on casse 89.92€ (analyse centralcharts).
Graphique journalier :

|
|
Réponses
103 Réponses
|
61 de 103
-
04/4/2022 08:11
 0
0
maywillow
Messages postés: 1331 -
Membre depuis: 27/1/2002
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
lundi que la Food and Drug Administration (FDA), l'autorité sanitaire
américaine, avait accepté d'accorder un examen prioritaire à son
médicament Dupixent pour le traitement des patients de 12 ans et plus
souffrant d'oesophagite à éosinophiles.
"La FDA devrait rendre sa décision sur cette indication expérimentale le 3 août 2022", a indiqué Sanofi dans un communiqué.
L'examen prioritaire est accordé par la FDA aux médicaments qui ont le
potentiel d'améliorer significativement le diagnostic, le traitement ou
la prévention de maladies graves.
L'oesophagite à éosinophiles est une maladie chronique et évolutive
portant une signature inflammatoire de type 2 qui provoque des lésions
dans l'oesophage et entraîne des difficultés à avaler. Aux États-Unis,
cette maladie concerne environ 160.000 personnes sous traitement, dont
approximativement 48.000 ont connu de multiples échecs thérapeutiques.
Dupixent est développé conjointement par Sanofi et Regeneron depuis
plus de dix ans dans le cadre d'un accord de collaboration mondiale.
Plus de 400.000 patients présentant certaines formes de dermatite
atopique, d'asthme et de polypose naso-sinusienne ont été traités par ce
médicament dans le monde.
-Julien Marion, Agefi-Dow Jones; +33 (0)1 41 27 47 94; jmarion@agefi.fr ed: DID
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
April 04, 2022 01:26 ET (05:26 GMT)
|
62 de 103
-
07/4/2022 08:33
 0
0
La Forge
Messages postés: 1348 -
Membre depuis: 03/8/2000
Sanofi: Bruxelles approuve Dupixent pour traiter l'asthme sévère de l'enfant
07 Avril 2022 - 07:38AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le laboratoire pharmaceutique Sanofi a
annoncé jeudi que la Commission européenne avait approuvé Dupixent
(dupilumab) pour le traitement des enfants âgés de six à 11 ans
présentant un asthme sévère avec signature inflammatoire de type
2.
Cette autorisation est fondée sur des données de phase 3 ayant
montré que, chez l'enfant, "Dupixent a significativement réduit les
crises d'asthme sévère et amélioré la fonction respiratoire et la
qualité de vie en lien avec la santé", a indiqué Sanofi dans un
communiqué.
L'asthme est l'une des maladies les plus courantes chez l'enfant et
jusqu'à 85% des enfants en souffrant peuvent présenter une
inflammation de type 2, ce qui peut avoir pour effet d'alourdir la
charge de la maladie. Non contrôlé, l'asthme peut avoir des
répercussions sur les activités de la vie quotidienne comme le
sommeil, la scolarité et la pratique sportive.
Dupixent est le seul médicament biologique indiqué dans l'Union
européenne pour le traitement de l'asthme sévère avec signature
inflammatoire de type 2, caractérisée par des éosinophiles sanguins
élevés et/ou une fraction de monoxyde d'azote expiré (FeNO)
élevée.
Dupixent est développé conjointement par Sanofi et Regeneron dans
le cadre d'un accord de collaboration mondiale.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
April 07, 2022 01:18 ET (05:18 GMT)
|
Message Banni
loulou35
(utilisateur banni)
Messages postés: 97 -
Membre depuis: 25/6/2019
|
Message Banni
loulou35
(utilisateur banni)
Messages postés: 97 -
Membre depuis: 25/6/2019
|
65 de 103
-
09/5/2022 08:02
 0
0
sarkasm
Messages postés: 1325 -
Membre depuis: 26/2/2009
ECHO BOURSE: JPMorgan Cazenove lance le suivi d'Euroapi à "surpondérer"
09 Mai 2022 - 06:53AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--JPMorgan Cazenove a lancé le suivi
d'Euroapi à "surpondérer" avec un objectif de cours de 17 euros. En
devenant indépendant de Sanofi, le producteur de principes actifs
pharmaceutiques présente un "potientiel d'accélération dans
l'obtention de contrats, en particulier dans le domaine des
services de CDMO" de développement de molécules, estiment les
analystes. L'action Euroapi a terminé à 13,51 euros vendredi, son
premier jour de cotation sur Euronext Paris. (adore@agefi.fr) ed:
JXM
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
May 09, 2022 01:33 ET (05:33 GMT)
|
66 de 103
-
16/5/2022 08:13
 0
0
adrian j boris
Messages postés: 316 -
Membre depuis: 28/6/2018
Sanofi: résultats positifs pour Sarclisa en association dans le myélome multiple
16 Mai 2022 - 06:32AM
Dow Jones News
Alerte
Imprimer
Share On Facebook
PARIS (Agefi-Dow Jones)--Le laboratoire pharmaceutique Sanofi a annoncé dimanche des résultats positifs pour son médicament Sarclisa, en association avec le carfilzomib et la dexaméthasone, dans le traitement de patients atteints d'un myélome multiple en rechute traités par un inhibiteur du protéasome.
"Les derniers résultats de l'essai clinique IKEMA de phase III évaluant Sarclisa en association avec le carfilzomib et la dexaméthasone montrent que cette association thérapeutique a permis d'obtenir une survie médiane sans progression de 35,7 mois, selon l'évaluation réalisée par un comité indépendant", a indiqué Sanofi dans un communiqué.
"Ces résultats attestent de la plus longue survie médiane sans progression jamais observée dans les études consacrées à un traitement de fond de deuxième ligne du myélome multiple en rechute par un inhibiteur du protéasome", a complété le laboratoire.
Le myélome multiple est le deuxième cancer hématologique le plus fréquent, avec plus de 130.000 nouveaux cas diagnostiqués chaque année dans le monde.
Sarclisa a déjà été approuvé dans un certain nombre de pays, dont les Etats-Unis et les pays de l'Union européenne, en association avec du pomalidomide et de la dexaméthasone dans le traitement du myélomemultiple en rechute ou réfractaire de l'adulte ayant reçu au moins deux traitements antérieurs.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31; ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
May 16, 2022 01:12 ET (05:12 GMT)
|
67 de 103
-
Modifié le 23/5/2022 09:20
 0
0
grupo
Messages postés: 1072 -
Membre depuis: 11/5/2004
Sanofi: la FDA approuve Dupixent pour traiter l'œsophagite à éosinophiles
23 Mai 2022 - 07:30AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
vendredi soir que la Food and Drug Administration (FDA), l'autorité
sanitaire américaine, avait autorisé l'utilisation de son
médicament Dupixent pour le traitement des patients de 12 ans et
plus souffrant d'oesophagite à éosinophiles.
"Avec cette approbation, Dupixent devient le premier et le seul
médicament expressément indiqué pour le traitement de l'oesophagite
à éosinophiles aux Etats-Unis", a indiqué Sanofi dans un
communiqué.
Dans cette indication, la FDA avait accepté au début du mois
d'avril d'accorder un examen prioritaire à Dupixent. L'examen
prioritaire est accordé par la FDA aux médicaments qui ont le
potentiel d'améliorer significativement le diagnostic, le
traitement ou la prévention de maladies graves.
Toujours dans cette même indication, une demande d'approbation de
Dupixent est actuellement examinée par l'Agence européenne des
médicaments et des soumissions réglementaires ailleurs dans le
monde sont également prévues d'ici à la fin de 2022.
L'oesophagite à éosinophiles est une maladie chronique et évolutive
portant une signature inflammatoire de type 2 qui provoque des
lésions dans l'oesophage et entraîne des difficultés à avaler. Aux
Etats-Unis, cette maladie concerne environ 160.000 personnes sous
traitement, dont approximativement 48.000 ont connu de multiples
échecs thérapeutiques.
Dupixent est développé conjointement par Sanofi et Regeneron depuis
plus de dix ans dans le cadre d'un accord de collaboration
mondiale. Plus de 400.000 patients présentant certaines formes de
dermatite atopique, d'asthme et de polypose naso-sinusienne ont été
traités par ce médicament dans le monde.
Fin mars dernier, Sanofi a porté son objectif de chiffre d'affaires
de Dupixent à plus de 13 milliards d'euros en rythme de
croisière.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
May 23, 2022 01:10 ET (05:10 GMT)
|
68 de 103
-
30/5/2022 12:29
 0
0
maywillow
Messages postés: 1331 -
Membre depuis: 27/1/2002
BOURSE: Sanofi et Ipsen sous pression après un bon parcours depuis janvier
30 Mai 2022 - 09:49AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Les actions Sanofi et Ipsen figurent lundi
parmi les plus fortes baisses de l'indice SBF 120, les valeurs du
secteur pharmaceutique subissant "de légères prises de bénéfices
alors qu'elles se distinguent depuis le début de l'année", observe
un analyste basé à Paris.
Le titre Sanofi se replie de 3,4%, à 98,93 euros, tandis que
l'action Ipsen abandonne 1,7%, à 93,80 euros. Depuis le début de
l'année, le cours de Bourse de Sanofi a gagné 12,3% et celui
d'Ipsen a avancé de 16,8%, tandis que le SBF 120 a plié de
7,9%.
Sanofi pâtit également d'un écueil réglementaire. Le groupe
pharmaceutique a averti lundi que la Food and Drug Administration
(FDA), l'autorité sanitaire américaine, l'avait informé que le
lancement de l'essai en condition réelle d'utilisation, prévu pour
appuyer sa demande de transfert de Cialis sur le marché de
l'automédication, avait été différé. La FDA a justifié cette
décision en invoquant des motifs "liés au protocole de l'essai",
selon Sanofi.
Cialis est prescrit pour le traitement des troubles de l'érection
ou des signes et symptômes de l'hypertrophie bénigne de la
prostate.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
May 30, 2022 04:29 ET (08:29 GMT)
|
69 de 103
-
31/5/2022 08:22
 0
0
gibbs1
Messages postés: 97 -
Membre depuis: 10/11/2019
Sanofi: la FDA accorde un examen prioritaire à Dupixent dans le prurigo nodulaire
31 Mai 2022 - 06:31AM
Dow Jones News
Alerte
Imprimer
Share On Facebook
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé mardi que la Food and Drug Administration (FDA), l'autorité sanitaire américaine, avait accepté d'accorder un examen prioritaire à sa demande supplémentaire de licence de produit biologique relative à son médicament Dupixent pour le traitement du prurigo nodulaire de l'adulte.
"La FDA devrait rendre sa décision le 30 septembre 2022", a indiqué Sanofi dans un communiqué. "Si cette indication est approuvée, Dupixent deviendra le premier médicament à usage systémique indiqué pour le traitement du prurigo nodulaire aux Etats-Unis", a ajouté le groupe pharmaceutique.
L'examen prioritaire est accordé par la FDA aux médicaments qui ont le potentiel d'améliorer significativement le diagnostic, le traitement ou la prévention de maladies graves.
Le prurigo nodulaire est une maladie chronique et inflammatoire de la peau qui provoque d'intenses démangeaisons et des lésions cutanées.
Dupixent est développé conjointement par Sanofi et Regeneron depuis plus de dix ans dans le cadre d'un accord de collaboration mondiale. Plus de 400.000 patients présentant certaines formes de dermatite atopique, d'asthme et de polypose naso-sinusienne ont été traités par ce médicament dans le monde.
Fin mars dernier, Sanofi a porté son objectif de chiffre d'affaires de Dupixent à plus de 13 milliards d'euros en rythme de croisière.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31; ddelmond@agefi.fr ed: ACD
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
May 31, 2022 01:11 ET (05:11 GMT)
|
70 de 103
-
08/6/2022 07:48
 0
0
sarkasm
Messages postés: 1325 -
Membre depuis: 26/2/2009
Sanofi: la FDA approuve Dupixent pour traiter la dermatite atopique du jeune enfant
08 Juin 2022 - 06:21AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
mardi soir que la Food and Drug Administration (FDA), l'autorité
sanitaire américaine, avait approuvé Dupixent pour le traitement
des patients âgés de six mois à cinq ans atteints de dermatite
atopique modérée à sévère, non contrôlés par des médicaments à
usage topique prescrits sur ordonnance ou auxquels ces médicaments
sont déconseillés.
La dermatite atopique est une maladie inflammatoire chronique de la
peau qui peut être invalidante.
"Dupixent est le premier et le seul médicament biologique approuvé
pour le traitement de la dermatite atopique modéré à sévère, de la
petite enfance jusqu'à l'âge adulte", a indiqué Sanofi dans un
communiqué.
Dupixent est approuvé dans plusieurs pays pour le traitement de la
dermatite atopique, de l'asthme et de la polypose nasosinusienne ou
de l'oesophagite à éosinophiles chez certaines catégories de
patients de différentes tranches d'âge.
Dupixent est actuellement approuvé dans ces indications aux
Etats-Unis et dans une ou plusieurs de ces indications dans l'Union
européenne, au Japon et dans plus de 60 pays. "Plus de 400.000
patients dans le monde ont déjà été traités par ce médicament", a
indiqué Sanofi.
Nom commercial du dupilumab, Dupixent est développé conjointement
par Sanofi et Regeneron dans le cadre d'un accord de collaboration
global. Fin mars dernier, Sanofi a porté son objectif de chiffre
d'affaires pour Dupixent à plus de 13 milliards d'euros en rythme
de croisière.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
June 08, 2022 01:01 ET (05:01 GMT)
|
71 de 103
-
24/6/2022 09:33
 0
0
maywillow
Messages postés: 1331 -
Membre depuis: 27/1/2002
Le vaccin de Sanofi et GSK avec l'antigène Bêta démontre son efficacité contre Omicron
24 Juin 2022 - 07:15AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique français Sanofi
et son partenaire britannique GlaxoSmithKline (GSK) ont annoncé
vendredi que leur candidat-vaccin contre le Covid-19 contenant
l'antigène Bêta avait démontré son efficacité et un profil de
sécurité favorable, notamment contre le variant Omicron du
coronavirus.
Une primovaccination avec ce candidat-vaccin contenant l'antigène
Bêta est efficace à 64,7% contre les infections symptomatiques chez
l'adulte et à 75,1% chez les participants précédemment infectés par
le coronavirus, selon les premières conclusions de l'essai en
cours. S'agissant du variant Omicron, l'analyse de séquençage
réalisée à ce jour montre une efficacité de 72% chez l'ensemble des
adultes et de 93,2% chez les personnes qui ont déjà été
infectées.
"Le vaccin de Sanofi et GSK est le premier candidat à démontrer son
efficacité, dans le cadre d'un essai contrôlé par placebo et dans
un contexte de circulation élevée du variant Omicron. Le vaccin a
présenté un profil de sécurité et de tolérance favorable", ont
indiqué les deux laboratoires pharmaceutiques dans un
communiqué.
Ces données, qui seront soumises aux autorités sanitaires,
confortent "le potentiel du vaccin de rappel de nouvelle génération
de Sanofi et GSK contenant l'antigène Bêta de constituer une
réponse pertinente aux besoins de santé publique", ont ajouté les
partenaires.
Dans le cadre du partenariat qui réunit les deux entreprises,
Sanofi fournit son antigène recombinant et GSK son adjuvant à usage
pandémique.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: LBO
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
June 24, 2022 01:55 ET (05:55 GMT)
|
72 de 103
-
28/6/2022 10:04
 0
0
maywillow
Messages postés: 1331 -
Membre depuis: 27/1/2002
Sanofi: la Commission européenne approuve les traitements Nexviadyme et Xenpozyme
28 Juin 2022 - 07:17AM
Dow Jones News
Alerte
Imprimer

PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
mardi que la Commission européenne avait approuvé ses médicaments
Nexviadyme, pour lutter contre la maladie de Pompe, et Xenpozyme,
comme première enzymothérapie substitutive indiquée pour le
traitement des manifestations non neurologiques du déficit en
sphingomyélinase acide.
"La Commission européenne a délivré une autorisation de mise sur le
marché à Nexviadyme, une enzymothérapie substitutive pour le
traitement au long cours des formes tardive et infantile de la
maladie de Pompe, une maladie musculaire rare, évolutive et
invalidante", a indiqué Sanofi dans un communiqué.
La maladie de Pompe peut se présenter sous deux formes : la forme
infantile, la plus grave qui apparait très tôt dans l'enfance, et
la forme tardive qui cause des atteintes progressives aux muscles.
Sans traitement spécifique, la forme infantile de la maladie évolue
par exemple vers une insuffisance cardiaque et le décès avant l'âge
de deux ans.
Nexviadyme était déjà dans plusieurs pays pour le traitement de
certaines catégories de patients atteints de la maladie de Pompe,
dont les pays de l'Union européenne, les Etats-Unis, le Japon, le
Canada, la Suisse, l'Australie, le Brésil, Taïwan et les Émirats
arabes unis.
Dans un communiqué séparé, Sanofi a indiqué que Bruxelles avait
approuvé Xenpozyme, "la première et la seule enzymothérapie
substitutive indiquée pour le traitement des manifestations non
neurologiques du déficit en sphingomyélinase acide chez l'enfant et
l'adulte présentant un déficit en sphingomyélinase acide de type
A/B ou de type B".
Le déficit en sphingomyélinase acide est une maladie génétique
évolutive extrêmement rare qui s'accompagne d'une morbidité et
d'une mortalité considérables, car pouvant se traduire par une
augmentation du volume de la rate ou du foie, des difficultés
respiratoires, des infections pulmonaires, des ecchymoses ou
saignements inhabituels.
En mars dernier, Xenpozyme a été approuvé au Japon dans le cadre du
programme Sakigake, marquant la première approbation de la molécule
olipudase alpha dans le monde. Aux Etats-Unis, où l'olipudase alpha
a obtenu la désignation de "médicament innovant" ("Breakthrough
Therapy"), l'examen de la demande de licence de produit biologique
("Biologics License Application") relative à cette molécule par la
Food and Drug Administration (FDA), l'autorité sanitaire
américaine, est en cours. La décision de la FDA est attendue en
octobre prochain.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: VLV
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
June 28, 2022 01:57 ET (05:57 GMT)
|
75 de 103
-
14/7/2022 08:07
 0
0
adrian j boris
Messages postés: 316 -
Membre depuis: 28/6/2018
Sanofi: résultats positifs pour le Dupixent dans l'œsophagite à éosinophiles de l'enfant
14 Juillet 2022 - 06:48AM
Dow Jones News
PARIS (Agefi-Dow Jones)--Le laboratoire pharmaceutique Sanofi a annoncé jeudi des résultats positifs dans l'essai de phase 3 portant sur l'utilisation expérimentale de son médicament Dupixent (dupilumab) chez l'enfant âgé de 1 à 11 ans souffrant d'œsophagite à éosinophiles.
L'essai a "atteint son critère d'évaluation primaire, qui correspondait à une rémission histologique de la maladie à 16 semaines, tant chez les patients ayant reçu la dose la plus élevée que la dose la plus faible", a indiqué Sanofi dans un communiqué.
L'œsophagite à éosinophiles est une maladie inflammatoire chronique qui altère l'œsophage et son fonctionnement, et pour laquelle il n'existe aucun traitement approuvé pour les enfants de moins de 12 ans, a rappelé Sanofi.
En mai dernier, la Food and Drug Administration (FDA), l'autorité sanitaire américaine, a autorisé l'utilisation du Dupixent pour le traitement des patients de 12 ans et plus souffrant d'oesophagite à éosinophiles.
"L'utilisation potentielle de Dupixent chez l'enfant âgé de 1 à 11 ans atteint d'œsophagite à éosinophiles fait actuellement l'objet d'un développement clinique et aucun organisme de réglementation n'a encore pleinement évalué ses profils de sécurité et d'efficacité", a précisé Sanofi.
"Ces données feront l'objet de discussions avec les autorités réglementaires de différents pays dans le monde, à commencer par celles des Etats-Unis d'ici à la fin de l'année", a ajouté le laboratoire.
L'anticorps monoclonal Dupixent, nom commercial du dupilumab, est développé conjointement par Sanofi et Regeneron dans le cadre d'un accord de collaboration global.
-Alice Doré, Agefi-Dow Jones; +33 (0)1 41 27 47 90; adore@agefi.fr ed: LBO
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
July 14, 2022 01:28 ET (05:28 GMT)
|
77 de 103
-
17/8/2022 14:01
 0
0
waldron
Messages postés: 9907 -
Membre depuis: 17/9/2002
BOURSE: Sanofi met un terme au développement de l'amcenestrant, l'action chute
17 Août 2022 - 10:00AM
Dow Jones News
PARIS (Agefi-Dow Jones)--L'action Sanofi accuse le plus fort repli
de l'indice SBF 120 mercredi, après l'annonce par le groupe
pharmaceutique de l'arrêt du programme mondial de développement
clinique de l'amcenestrant, un traitement expérimental oral contre
certains cancers du sein.
Vers 9h40, le titre Sanofi perdait 4,1%, à 83,08 euros.
La décision de Sanofi d'arrêter de développement de l'amcenestrant
repose sur les résultats d'une analyse des données de l'essai de
phase 3 AMEERA-5 qui a évalué ce traitement en association avec du
palbociclib, comparativement au létrozole en association avec du
palbociclib, chez des patientes atteintes d'un cancer du sein au
stade avancé.
Un comité indépendant de suivi des données a constaté que,
comparativement au groupe témoin, l'amcenestrant en association
avec du palbociclib n'avait pas atteint le seuil justifiant la
poursuite du traitement et a donc recommandé l'arrêt de
l'essai.
Sanofi compte continuer d'évaluer les données de l'essai et
"prévoit de communiquer prochainement ses résultats à la communauté
scientifique". Toutes les autres études consacrées à
l'amcenestrant, en particulier dans le traitement du cancer du sein
au stade précoce (AMEERA-6), seront arrêtées, a indiqué le groupe
pharmaceutique dans un communiqué.
En mars dernier, Sanofi avait prévenu que l'essai clinique AMEERA-3
de phase 2 concernant l'amcenestrant, mené chez des patientes
présentant un cancer du sein au stade avancé ou métastatique,
n'avait pas atteint son critère d'évaluation primaire, à savoir
l'amélioration de la survie sans progression, par rapport au
traitement endocrinien standard.
-Dimitri Delmond, Agefi-Dow Jones; +33 (0)1 41 27 47 31;
ddelmond@agefi.fr ed: LBO
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
August 17, 2022 03:40 ET (07:40 GMT)
|
78 de 103
-
08/9/2022 21:39
 0
0
waldron
Messages postés: 9907 -
Membre depuis: 17/9/2002
Sanofi: Dupixent améliore significativement les signes et symptômes du prurigo nodulaire
08 Septembre 2022 - 06:22PM
Dow Jones News
PARIS (Agefi-Dow Jones)--Le laboratoire pharmaceutique Sanofi a
annoncé jeudi que Dupixent, un médicament utilisé pour traiter
plusieurs maladies inflammatoires, améliorait "significativement"
les signes et symptômes du prurigo nodulaire, selon des données de
phase III de dernière heure présentées au congrès de l'EADV
(European Academy of Dermatology and Venereology).
"A 24 semaines, près de trois fois plus de patients traités par
Dupixent ont présenté une diminution cliniquement significative de
leurs démangeaisons et lésions cutanées, comparativement à ceux
traités par placebo", a souligné Sanofi dans un communiqué.
"Il n'existe actuellement aucun médicament approuvé expressément
pour le traitement du prurigo nodulaire", a précisé le groupe
pharmaceutique.
"La demande d'approbation aux Etats-Unis fait l'objet d'un examen
prioritaire" et la demande d'approbation dans l'Union européenne
est en cours d'examen, a ajouté Sanofi.
-Eric Chalmet, Agefi-Dow Jones; +33 (0)1 41 27 47 95;
echalmet@agefi.fr ed: JEB
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
September 08, 2022 12:02 ET (16:02 GMT)
|
79 de 103
-
01/12/2022 11:58
 0
0
grupo
Messages postés: 1072 -
Membre depuis: 11/5/2004
UBS a renouvelé jeudi son opinion 'neutre' sur le titre Sanofi, se disant 'surpris' de voir figurer le nom du laboratoire parmi les éventuels repreneurs d'Horizon.
Si l'analyste juge qu'une transaction apparaît tout à
fait 'faisable' d'un point de vue financier, sans réellement menacer l'équilibre des comptes du groupe, il s'interroge en revanche sur la nécessité de mener à bien une telle opération.
D'après
l'intermédiaire, un rapprochement apporterait certes à Sanofi un portefeuille diversifié de médicaments de spécialité, mais ne résoudrait pas les enjeux stratégique que son récent échec du groupe dans le cancer du sein a mis en lumière, à savoir la qualité de son 'pipeline' et la productivité de ses activités de recherche et développement (R&D).
Son objectif de cours à 12 mois demeure inchangé, à 92 euros.
|
80 de 103
-
02/12/2022 10:02
 0
0
grupo
Messages postés: 1072 -
Membre depuis: 11/5/2004
Sanofi: une éventuelle offre sur Horizon sera uniquement en numéraire
02 Décembre 2022 - 08:45AM
Dow Jones News
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a indiqué
vendredi qu'une éventuelle offre d'achat de sa part sur Horizon
Therapeutics se ferait uniquement en numéraire.
Cette annonce est effectuée conformément à la réglementation
irlandaise sur les offres publiques d'achat, a précisé Sanofi.
Le groupe français a ajouté qu'il n'y avait aucune certitude quant
à la remise effective d'une offre, ni quant aux termes de cette
proposition le cas échéant.
Le laboratoire pharmaceutique Horizon Therapeutics, qui a son siège
social en Irlande, a confirmé mardi qu'il suscitait l'intérêt de
repreneurs potentiels, dont Sanofi. Une transaction portant sur
Horizon serait de taille. Le laboratoire affichait une
capitalisation boursière de 22,8 milliards de dollars jeudi à la
clôture de Wall Street.
-Pierre-Jean Lepagnot, Agefi-Dow Jones +33 (0)1 41 27 47 95;
pjlepagnot@agefi.fr ed: LBO
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
December 02, 2022 02:25 ET (07:25 GMT)
|
|
103 Réponses
|
|
Messages à suivre: (103)
Dernier Message: 05/Fév/2024 07h40
|
|
 Hot Features
Hot Features
PARIS (Agefi-Dow Jones)--Le groupe pharmaceutique Sanofi a annoncé
lundi que la Food and Drug Administration (FDA), l'autorité sanitaire
américaine, avait accepté d'accorder un examen prioritaire à son
médicament Dupixent pour le traitement des patients de 12 ans et plus
souffrant d'oesophagite à éosinophiles.
"La FDA devrait rendre sa décision sur cette indication expérimentale le 3 août 2022", a indiqué Sanofi dans un communiqué.
L'examen prioritaire est accordé par la FDA aux médicaments qui ont le
potentiel d'améliorer significativement le diagnostic, le traitement ou
la prévention de maladies graves.
L'oesophagite à éosinophiles est une maladie chronique et évolutive
portant une signature inflammatoire de type 2 qui provoque des lésions
dans l'oesophage et entraîne des difficultés à avaler. Aux États-Unis,
cette maladie concerne environ 160.000 personnes sous traitement, dont
approximativement 48.000 ont connu de multiples échecs thérapeutiques.
Dupixent est développé conjointement par Sanofi et Regeneron depuis
plus de dix ans dans le cadre d'un accord de collaboration mondiale.
Plus de 400.000 patients présentant certaines formes de dermatite
atopique, d'asthme et de polypose naso-sinusienne ont été traités par ce
médicament dans le monde.
-Julien Marion, Agefi-Dow Jones; +33 (0)1 41 27 47 94; jmarion@agefi.fr ed: DID
Agefi-Dow Jones The financial newswire
(END) Dow Jones Newswires
April 04, 2022 01:26 ET (05:26 GMT)